|
||||||||
Амоніак: будова молекули, одержання в лабораторії. Фізичні та хімічні властивості амоніаку
Амоніак: будова молекули, одержання в лабораторії. Фізичні та хімічні властивості амоніаку. Взаємодія з киснем, водою, кислотами. Застосування амоніаку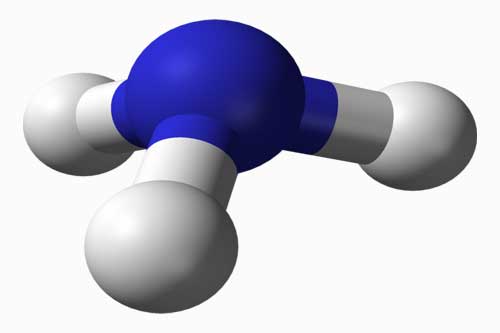 Молекулярна формула аміаку NH3. У молекулі аміаку атом Нітрогену пов’язаний із трьома атомами Гідрогену ковалентним полярним зв’язком. Густина його зміщена у бік атома Нітрогену, як більш електронегативного. І тому молекула аміаку являє собою диполь. Молекулярна формула аміаку NH3. У молекулі аміаку атом Нітрогену пов’язаний із трьома атомами Гідрогену ковалентним полярним зв’язком. Густина його зміщена у бік атома Нітрогену, як більш електронегативного. І тому молекула аміаку являє собою диполь.У лабораторії аміак добувають слабким нагріванням суміші амоній хлориду NH4Cl з гашеним вапном Ca(OH)2. 2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O. За звичайних умов аміак - це газ безбарвний, має різкий характерний запах, набагато легший за повітря, дуже добре розчиняється у воді. В 1 об’ємі води за кімнатної температури розчиняється сімсот об’ємів аміаку. Розчин аміаку у воді називається аміачного водою, або нашатирним спиртом Аміак зріджується при температурі мінус тридцять три градуси. ЧИТАЙТЕ ТАКОЖ: Солі амонію. Фізичні властивості солей амонію. Хімічні властивості: взаємодія з лугами, солями, розкладання під час нагрівання Для аміаку характерні такі хімічні властивості: - він окислюється киснем до вільного азоту N2 і води. 4NH3 + 3O2 → 2N2 + 6H2O. А за наявності платинового каталізатора замість вільного азоту утворюється нітроген (II) оксид NO і вода: 4NH3 + 5O2 4NO + 6H2O; аміак реагує з водою з утворенням амоній гідроксиду NH4OH і з кислотами з утворенням солей амонію: NH3 + HCl → NH4Cl. Фізичні й хімічні властивості аміаку зумовили його широке застосування. Великі кількості аміаку витрачаються для добування нітратної кислоти, сечовини, соди. На легкому зрідженні та наступному випаровуванні аміаку з поглинанням тепла ґрунтується його застосування у холодильній справі. Рідкий аміак і його водні розчини використовуються як рідке добриво. | ||
|
Схожі матеріали:
| ||
| Всього коментарів: 0 | |
|
ЗАРАЗ ЧИТАЮТЬ
|
|
|
 |  |
 |  |
 |  |
 |  |
 |  |