|
||||||||
Нітроген і Фосфор, їх місце в Періодичній системі будови атомів. Алотропні модифікації Фосфору
Нітроген і Фосфор, їх місце в Періодичній системі будови атомів. Алотропні модифікації Фосфору. Азот і Фосфор як прості речовини: будова молекул, поширення в природі. Фізичні властивості азоту і фосфору. Хімічні властивості азоту та фосфору: взаємодія з металами, воднем, киснем. Застосування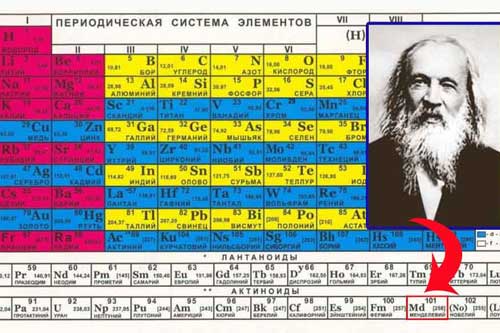 Нітроген і Фосфор у Періодичній системі хімічних елементів знаходяться в головній підгрупі п’ятої групи. На зовнішньому енергетичному шарі обидва елемента містять по 5 електронів у стані s2p3. Тому найвищий ступінь окиснення цих елементів дорівнює +5, найнижчий - –3. Нітроген і Фосфор у Періодичній системі хімічних елементів знаходяться в головній підгрупі п’ятої групи. На зовнішньому енергетичному шарі обидва елемента містять по 5 електронів у стані s2p3. Тому найвищий ступінь окиснення цих елементів дорівнює +5, найнижчий - –3.Відмінність полягає у тому, що в атомі Фосфору на зовнішньому електронному шарі є вільні d-орбіталі. Це дає можливість йому приходити у збуджений стан. Хімічний елемент Нітроген не утворює алотропних модифікацій. У вільному стані існує у формі лише однієї простої речовини - азоту. Молекула азоту складається з двох атомів, має формулу N2. Хімічний зв’язок у ній ковалентний неполярний і дуже міцний, бо атоми утримуються потрійним зв’язком. За звичайних умов азот - газ без кольору, запаху і смаку, легший за повітря. Зріджується при температурі –196° і твердне при температурі –210°. У воді розчиняється гірше, ніж кисень. Це пояснюється неполярністю його молекул. На відміну від Нітрогену, хімічний елемент Фосфор утворює кілька алотропних модифікацій, які відрізняються між собою за будовою молекул і властивостями. Це - білий, червоний і чорний фосфор. ЧИТАЙТЕ ТАКОЖ: Амоніак: будова молекули, одержання в лабораторії. Фізичні та хімічні властивості амоніаку Білий фосфор - м’яка, безбарвна кристалічна речовина, схожа на віск. Має молекулярні кристалічні ґратки, у вузлах яких розміщені тетраедричні молекули P4. Летка, легкоплавка речовина, має характерний запах часнику. Не розчиняється у воді, але добре розчиняється у сірковуглеці CS2 і бензині. Легкозаймиста речовина, тому зберігають її під водою. Білий фосфор у темряві на повітрі світиться зеленкувато-жовтим світлом. Це явище називається люмінесценція. Воно спричиняється повільним окисненням білого фосфору. Білий фосфор - надзвичайно отруйна речовина, навіть у малих дозах. 50 мг білого фосфору - смертельні! При тривалому слабкому нагріванні білий фосфор переходить у червоний. Червоний фосфор - порошок червоно-бурого кольору, неотруйний. Має атомні кристалічні ґратки. Не розчиняється у воді і сірковуглеці. Без запаху, у темряві не світиться. Встановлено, що червоний фосфор є сумішшю кількох алотропних модифікацій, які відрізняються одна від одної кольором - від яскраво-червоного до фіолетового. Червоний фосфор легко вбирає вологу, тобто є гігроскопічним. При нагріванні без доступу повітря випаровується, а при охолодженні його пара перетворюється на білий фосфор. Чорний фосфор - речовина, схожа на графіт, масна на дотик, має металічний блиск, не отруйний, виявляє властивості напівпровідників. Добувають чорний фосфор тривалим нагріванням білого фосфору під великим тиском. У природі Нітроген зустрічається як у вільному стані, так і у зв’язаному. У вільному стані Нітроген у вигляді азоту входить до складу повітря. У повітрі азоту 78 % за об’ємом, або 76 % за масою. Сполуки Нітрогену в невеликих кількостях є у ґрунті. Також він входить до складу білкових речовин і багатьох природних органічних сполук. На відміну від Нітрогену, Фосфор зустрічається в природі тільки в сполуках. Найважливіші його мінерали - це фосфорити й апатити. До їх складу Фосфор входить у вигляді кальцій ортофосфату Ca3(PO4)2. Фосфор входить також до складу білкових речовин. За хімічною активністю азот менш активний, ніж фосфор. Це пояснюється наявністю потрійного зв’язку в його молекулі. Азот і фосфор мають такі хімічні властивості: 1) реагують із багатьма металами при нагріванні, утворюючи відповідно нітриди і фосфіди. Лише з літієм азот реагує за звичайної температури, утворюючи ліній нітрид (Li3N): 6Li + N2 → 2Li3N; 2) реагують із неметалами. З воднем азот взаємодії при нагріванні, високому тиску і в присутності каталізатора. При цьому утворюється аміак NH3: N2 + 3H2 → 2NH3. Фосфор із воднем практично не взаємодіє. У реакціях із металами і воднем азот і фосфор виступають як окисники. З киснем азот сполучається за температури електричної дуги, понад 2000 °С, утворюючи нітроген (II) оксид NO: N2 + O2 → 2NO. Фосфор під час горіння в кисні утворює фосфор(V) оксид P2O5. А під час повільного окиснення утворюється фосфор(III) оксид P2O3. ЧИТАЙТЕ ТАКОЖ: Солі амонію. Фізичні властивості солей амонію. Хімічні властивості: взаємодія з лугами, солями, розкладання під час нагрівання Азот у великих кількостях використовується для добування аміаку. Білий фосфор широкого застосування не має. Звичайно його використовують у фармацевтичних препаратах, а також для утворення димових завіс. Червоний фосфор використовується у виробництві сірників. Чорний фосфор застосовується дуже рідко. | ||
|
Схожі матеріали:
| ||
| Всього коментарів: 0 | |
|
ЗАРАЗ ЧИТАЮТЬ
|
|
|
 |  |
 |  |
 |  |
 |  |
 |  |













